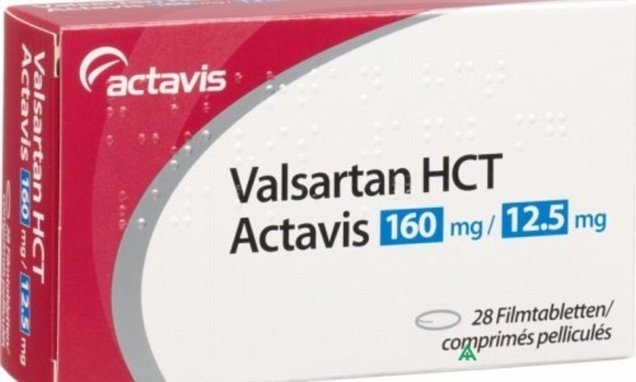
Cục Quản lý dược (Bộ Y tế) vừa có công văn gửi Sở Y tế các tỉnh, thành phố trực thuộc Trung ương, các cơ sở sản xuất, kinh doanh thuốc về việc đình chỉ lưu hành tất cả các thuốc thành phẩm theo danh mục 23 loại thuốc được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất đang lưu hành tại Việt Nam.
|
|
|
Ảnh minh họa (Nguồn: Internet) |
Cục Quản lý dược yêu cầu các công ty đăng ký thuốc, sản xuất thuốc, công ty nhập khẩu cần phối hợp với các nhà phân phối thuốc thông báo thu hồi tất cả các lô thuốc thành phẩm trong công thức sản xuất có chứa nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất theo danh mục kèm theo tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc.
Đồng thời, Cục yêu cầu ngừng ngay việc sử dụng nguyên liệu này để sản xuất thuốc thành phẩm; thực hiện đánh giá nhà cung cấp, kiểm tra, nghiên cứu sử dụng nguyên liệu Valsartan của nhà sản xuất mới nhằm đảm bảo yêu cầu về chất lượng, an toàn cho người sử dụng và thực hiện thủ tục thay đổi hồ sơ đăng ký thuốc theo đúng quy định của pháp luật. Yêu cầu các công ty gửi báo cáo thu hồi về Cục Quản lý dược trong vòng một tháng kể từ ngày ký công văn.
Sở Y tế các tỉnh, thành phố thông báo việc thu hồi tới các cơ sở kinh doanh, sử dụng thuốc trên địa bàn; công bố thông tin việc thu hồi tất cả các thuốc thành phẩm được sản xuất từ nguyên liệu Valsartan do Công ty Zhejiang Huahai Pharmaceutical-Trung Quốc sản xuất trên trang thông tin điện tử của Sở. Đồng thời, Sở Y tế các địa phương kiểm tra và giám sát các công ty kinh doanh trên địa bàn thực hiện việc thu hồi các lô thuốc có nguyên liệu nêu trên, xử lý các đơn vị vi phạm theo quy định.
Vũ Hồng